Что такое таурин?
Таурин был открыт в 1827 году в числе компонентов бычьей желчи, откуда и получил свое название — «taurus» в переводе с латыни означает «бык».
В отличие от других аминокислот таурин отсутствует в мышцах или других тканях организма. Для него характерна свободная несвязанная форма или же присутствие в составе коротких цепочек аминокислот, называемых пептидами. Особого значения открытие таурина не получило до тех пор, пока в 1970 году ученые не обнаружили его незаменимость в качестве элемента питания кошек. Без него у животных развивалась ретинальная дегенерация, приводящая к слепоте и серьезным проблемам с работой сердца.
Наблюдения за животными навели ученых на мысль о пользе таурина для людей. Исследования обнаружили, что у младенцев, вскармливаемых искусственным питанием вместо материнского молока, часто развивается дефицит таурина, поскольку организму не хватает синтезирующего его энзима. Таурин производится из двух аминокислот, заменимой и незаменимой — метионина и цистеина, содержащих серу.
Некоторые ученые полагают, что таурин - это вовсе не аминокислота, так как он содержит кислую сульфо-группу, в то время как другие аминокислоты содержат карбоксильную группу. В организме таурина довольно много — он есть в мозге, скелете и сердечной мышце. По своему количеству он уступает только глютамину. Но если таурин присутствует в мышцах, на то должна быть своя причина.
Организм может синтезировать таурин из метионина и цистеина только в присутствии активированной формы витамина В6, или пиридоксина. Следовательно, недостаток этого витамина может затормозить синтез таурина. Механизм синтеза таурина вызывает споры. Главный энзим, вовлеченный в этот процесс, слабо активен как у людей, так и у животных, поэтому ученые предположили, что дополнительное потребление таурина в виде пищевой добавки может оказаться полезным.
Самая изученная функция таурина — его роль в производстве желчных солей. Желчь состоит в основном из холестерина, который производится в печени и сохраняется в желчном пузыре. Основной способ, которым организм избавляется от лишнего холестерина, это использование его для производства желчи. Желчь способствует усвоению жиров, уменьшая их количество и облегчая переработку жира пищеварительными энзимами.
Однако желчь недостаточно растворима, если она не конъюгирована, то есть, не соединена с другими веществами. В этом случае она превращается в желчные соли. Главными конъюгирующими агентами являются глицин и таурин. Таким образом, таурин способствует синтезу желчных солей и снижает уровень холестерина в крови, удерживая липопротеины низкой плотности (вредный вид холестерина) от проникновения в кровоток. Высокий уровень ЛНП является главным фактором риска сердечнососудистых заболеваний, особенно в оксидированном состоянии. Чем ниже ЛНП, тем меньше риск заболеваний сердца и сосудов.
Таурин ускоряет образование желчных солей, активизируя гены, ответственные за синтез энзима 7-альфа гидроксилазы. Усиление использования холестерина для синтеза желчи снижает его уровень в крови, что в свою очередь увеличивает рецепторы ЛНП в клетках, еще более понижая холестерин.
Как мы знаем, протеины состоят из аминокислот и в конечном итоге на них же и расщепляются. Общее число аминокислот — 22. Все они делятся на заменимые и незаменимые. Незаменимые аминокислоты не могут синтезироваться в организме. Человек получает их из пищи. Баланс незаменимых аминокислот в любом протеине определяет его биологическую ценность. В животных протеинах незаменимых аминокислот больше, и по составу они ближе к протеинам организма человека. По своей ценности животные протеины превосходят растительные белки, в которых незаменимых аминокислот мало или нет вообще.
Научные изыскания показывают, что незаменимые аминокислоты исключительно важны для синтеза мышечного протеина. Всего лишь 6 г в день ускоряют белковый синтез после упражнений с отягощениями. В то же время сведения о важности незаменимых аминокислот могут привести к ошибочному выводу о том, что заменимые аминокислоты не так важны. Но это не так. Некоторые из заменимых аминокислот классифицируются как кондиционно незаменимые, поскольку при определенных обстоятельствах (например, в условиях повышенного стресса) организм не успевает вырабатывать их в достаточном количестве. Таким образом заменимые аминокислоты становятся незаменимыми. К таким аминокислотам относятся глютамин и аргинин. При нормальном спортивном питании организм синтезирует эти аминокислоты самостоятельно, но в исключительных случаях может испытывать острый их дефицит.
Глютамин и аргинин — довольно популярные добавки среди бодибилдеров и других атлетов. Первый привлек внимание спортсменов в связи с успешным использованием его для пациентов больниц. Особенно эффективно глютамин показал себя в случаях лечения ожогов, когда человек теряет очень много протеина. Потребление глютамина тормозит катаболические процессы в мышцах, что и обусловило его появление в качестве пищевой добавки в арсенале интенсивно тренирующихся спортсменов. Последующие исследования показали его эффективность в укреплении иммунитета, ослабленного слишком интенсивными и продолжительными тренировками.
Аргинин раньше считался средством стимуляции высвобождения гормона роста, в медицинской практике инъекции аргинина делаются больным с дефицитом ГР. Те или иные его формы входят в состав различных пищевых добавок, в частности тех, которые поднимают уровень оксида азота.
Многие добавки с глютамином и/или аргинином часто включают в себя еще одну аминокислоту — таурин. Особенно часто он включается в состав креатиновых продуктов. Креатин повышает клеточную гидратацию, что является сигналом увеличения синтеза мышечного протеина. Глютамин и таурин также повышают гидратацию, что делает их синергистами креатина.
Если бы таурин вызывал исключительно гидратацию, то уже по этой причине его можно было бы считать полезной пищевой добавкой. Но, являясь кондиционно незаменимой аминокислотой (подобно глютамину и аргинину), он необходим тренирующимся людям гораздо сильнее, чем можно было бы предположить.
В ходе семинедельного эксперимента ученые наблюдали за влиянием потребления 3 г таурина в день тридцатью страдающими избыточным весом студентами колледжа (1). Часть группы получала плацебо. Таурин снизил уровень триглицеридов в крови и улучшил атерогенный индекс (отношение ЛНП к ЛВП). Таурин увеличивает производство ЛВП, способствуя активности его протеина-переносчика, аполипопротеина А-1.
Кроме того, у студентов, принимавших таурин, проявился положительный побочный эффект, а именно — уменьшение количества подкожного жира. Опыты над крысами показали, что таурин предотвращает накопление абдоминального жира, считающегося наиболее опасным для здоровья и связанным с инсулинорезистентностью, сердечными заболеваниями и диабетом.
Таурин также обладает антиоксидативным действием, защищая организм от сердечнососудистых заболеваний и рака. Разрушая чужеродные организмы, иммунные клетки высвобождают свободные радикалы — нестабильные кислородные метаболиты, которые уничтожают клеточные мембраны чужаков и убивают их. Но те же свободные радикалы способны повреждать и нормальные ткани. При нормальном уровне таурина в организме, он связывает и нейтрализует избыток свободных радикалов.
Курение повреждает выстилку кровеносных сосудов и вызывает различные заболевания. В 2003 году ученые обнаружили, что при приеме таурина курильщиками состояние эндотелия сосудов быстро приближается к состоянию людей некурящих. Такой эффект был замечен всего лишь в течение пяти дней приема 1,5 г таурина в сутки — примерно такое же количество таурина содержится в 100-граммовой порции рыбы.
Хотя самыми полезными для здоровья компонентами рыбы считаются омега-3 жиры, таурин играет не менее значительную роль. Некоторые исследования показали, что он снижает кровяное давление и нивелирует негативное влияние высокого потребления соли. Стрессы вызывают подъем кровяного давления в связи с высвобождением эпинефрина и норэпинефрина, сужающих сосуды. Таурин противостоит этому процессу, снижая давление. (Интересно, что самый низкий уровень сердечнососудистых заболеваний наблюдается у жителей Японии и средиземноморских стран, чьи диеты отличаются высоким содержанием таурина.)
Таурин защищает сердце еще и тем, что изменяет электролитную функцию. Избыток кальция может быстро привести к смерти клетки — этому противостоит таурин. Кроме того, он регулирует баланс натрия и калия в сердечных волокнах, поддерживая тем самым работу сердца.
Как уже не раз отмечалось, рафинированные сахара несут немалую ответственность за эпидемию ожирения в мире, особенно среди молодежи. Избыток фруктозы депонирует сахар в протеиновых волокнах (это называется гликацией), что считается главной причиной старения и потери тканями эластичности.
В ходе недавнего эксперимента крысы в течение 30 дней питались по диете, на 60% состоявшей из фруктозы и на 2% — из таурина. Диета предотвратила формирование конечных продуктов гликации и улучшила усвоение глюкозы. Некоторые исследования показали, что таурин способен предотвращать серьезные диабетические осложнения, включая нейропатию (дегенерацию нервов) и ретинопатию (слепоту).
Может ли таурин помочь тренировкам?
В медленносокращающихся волокнах количество таурина больше, чем в быстросокращающихся, Повсей видимости, это связано с тем, что у первых большая оксидативная мощность, а таурин обладает антиоксидативными свойствами. Ученые заметили, что организм теряет довольно много таурин а во время интенсивных анаэробных тренировок.
Опыты над крысами показали, что таурин увеличивает выносливость, особенно у престарелых животных. Другое исследование в области новейшего спортивного питания обнаружило, что таурин помогает в защите от вызываемых упражнениями мышечных повреждений. Ученые наблюдали за тем, как потребление дополнительного таурина обратило «некоторые типы функциональных дефицитов в скелетных мышцах».
Последующий эксперимент с участием людей подтвердил защитные свойства таурина. Вследствие усиленного потребления кислорода в мышцах увеличивается производство опасных свободных радикалов, способных повредить ДНК в клетках, что может привести к мутациям, paку и другим неприятным последствиям. В данном исследовании прием таурина перед тренировкой значительно сократил повреждения ДНК, что объясняется его антиоксидативными свойствами. К тому же, участники эксперимента показали увеличение максимального потребления кислорода (показатель выносливости), увеличение способности тренироваться дольше и повышение максимальной рабочей нагрузки. Такие эффекты могут быть следствием роли таурина в увеличении сердечной мощности и улучшении электрических и сократительных свойств скелетных мышц.
В мышцах таурин стабилизирует клеточные мембраны, в том числе сарколемму, окружающую мышечные волокна, контролируя проникновение кальция в клетку, таурин способствует мышечным сокращениям.
Влиянием таурина на функцию электролитов в мышце можно также объяснить причину, по которой он помогает предотвратить мышечные судороги. Одна из теорий предполагает, что судороги возникают вследствие потерь натрия и калия во время тренировки. Таурин способен предотвратить эти потери.
В ходе недавнего эксперимента выяснилось, что содержание таурина в быстро сокращающихся волокнах значительно снижается во время длительных тренировок. Кроме того, таурин усиливает работу мышечных энзимов, регулирующих производство энергии и оксидацию жиров - Также таурин стимулирует циклический AMP, что ведет к увеличению выхода катехоламинов, таких как эпинефрин и норэпинефрин. Оба они активизируют энзим гормоночувствительную липазу в жировых клетках, что ведет к активации высвобождения жиров для использования в энергетических целях во время выполнения упражнений.
Предостережение
Прием пищевых добавок с таурином имеет отдельные недостатки. Оптимальная для повышения спортивной результативности доза была выявлена в результате опытов над крысами — от 100 до 500 мг на килограмм веса тела (8). Доза зависит от массы тела и для человека будет, скорее всего, гораздо меньшей. Хорошими источниками таурина являются все животные протеиновые продукты, в особенности морепродукты.
Аминокислота бета-аланин сегодня входит в состав различных пищевых добавок, так как она является предшественником синтеза L--карнозина. Бета-аланин и таурин в организме конкурируют за транспорт. Но первый может блокировать усвоение второго на 50% и более, поэтому принимать их лучше в разное время.
Напоследок, вам следует знать, что таурин оказывает подавляющее действие на работу мозга. Поэтому разовый прием таурина в слишком высокой дозе может вызвать чувство утомления и нехватки энергии. Малые дозы таурина (менее 1 г) оказывают обратный эффект — подъем энергии. Теперь понятно, какой ингредиент является главным в составе энергетических напитков, чьи названия содержат в себе слово «bull» («бык»)? Впрочем, из-за наличия в таких напитках большого процента кофеина, таурин из них можно было бы смело исключить.
Таурин (2-аминоэтансульфоновая кислота) – широко распространенная аминокислота, содержащаяся в миллимолярных концентрациях во всех тканях млекопитающих. Цитопротективное действие таурина на различные ткани подтверждалось не раз. Таурин регулирует различные клеточные функции, включая антиоксидацию, модуляцию ионного транспорта, осморегуляцию, регуляцию нейротрансмиттеров, конъюгацию желчных кислот и др. [38, 74, 75, 79]. Источники таурина в организме – это внутренний биосинтез и потребление с пищей. Таурин синтезируется из метионина и цистеина в основном в печени. Хорошо известно, что способность к биосинтезу таурина у человека крайне низка, у кошек она отсутствует вовсе, в то время как у грызунов уровень биосинтеза таурина достаточно высок [29]. Кроме биосинтеза, таурин может поступать в организм напрямую вместе с мясными и морскими продуктами. Особенно богаты таурином морепродукты.
Yamori с соавт. [98] в международном эпидемиологическом исследовании показали, что экскреция таурина с мочой (как маркер уровня потребления таурина с пищей) находится в обратной корреляционной зависимости с уровнем летальности от ишемической болезни сердца. Более того, употребление кошками таурин-дефицитной пищи приводит к развитию таких патологических процессов, как дистрофия сетчатки, нарушение репродуктивной функции и дилатационная кардиомиопатия [32, 72, 84]. Кроме того, таурин является жизненно необходимым веществом и его недостаточность в пище человека может негативно отразиться на различных тканях организма, а его назначение, напротив, оказывает лечебный эффект при различных патологиях. Накопленные на сегодняшний день данные показывают эффективность дополнительного приема таурина при как инсулин-зависимом, так и инсулин-независимом сахарном диабете, а также при инсулинрезистентности [22–23, 29, 76]. Кроме того, таурин оказывают благоприятный эффект в ходе терапии диабетических осложнений, включая ретинопатию, нефропатию, нейропатию, атеросклероз и кардиомиопатию. В основе этих эффектов лежит разностороннее действие таурина на функциональную активность клеток. В данной статье авторы обсуждают благоприятные эффекты (и их молекулярные механизмы), оказываемые таурином на течение сахарного диабета.
Влияние таурина на гипергликемию у животных с моделью сахарного диабета и его возможные механизмы
Влияние таурина на модели сахарного диабета типа 1
Эффекты, оказываемые таурином на течение сахарного диабета типа 1 (СД 1-го типа), хорошо изучены. Назначение таурина крысам со стрептозотоцин-индуцированным сахарным диабетом (STZ-ИСД) до начала его развития подавляло гипергликемию и снижало уровни гликированного гемоглобина, холестерина и триглицеридов в плазме крови [2, 88–89]. Более того, таурин снижал уровень продуктов перекисного окисления липидов (ПОЛ), активированный при СД 1-го типа. Учеными были получены данные о том, что таурин может предупреждать развитие гипергликемии у кроликов с моделью аллоксанового СД [87, 95]. При этом важно отметить, что если таурин назначали животным при развитии СД 1-го типа, снижения уровня гипергликемии не наблюдалось [26]. Это говорит о том, что тауринзависимое снижение уровня глюкозы в крови в экспериментальной модели СД 1-го типа может быть связано с протективным действием таурина на β-клетки, в частности их защитой от повреждающего эффекта стрептозоцина или аллоксана [11, 25]. Примечательно, что назначение таурина спустя 2 дня после инъекции стрептозоцина увеличивало выживаемость крыс, больных СД [16]. Эти данные говорят о том, что таурин может повышать резистентность организма к ряду стрессорных воздействий, вызываемых гипергликемией, что, по-видимому, играет роль в лечебном действии таурина при осложнениях СД (о чем будет сказано ниже).
Мыши линии NOD (non-obese diabetes, диабет без ожирения) – это генетическая животная модель аутоиммунного диабета человека, который развивается вследствие инфильтрации мононуклеарными лейкоцитами островков поджелудочной железы. Добавление таурина беременным самкам этой линии до рождения их детенышей значительно увеличивало массу панкреатических островков у рожденных мышат [4], из чего можно сделать вывод о том, что таурин влияет на развитие островков. Кроме того, лечение таурином задерживало (а у 20% мышат-самок предупреждало) развитие СД.
Влияние таурина на модели сахарного диабета, индуцированного ожирением
Крысы линии OLETF (Otsuka Long-Evans Tokushima Fatty) являются моделью инсулиннезависимого диабета, который характеризуется гипергликемией, резистентностью к инсулину и отложением жира в брюшной полости. Показано, что таурин снижает гипергликемиюи резистентность к инсулину у крыс линии OLETF [31, 58]. Кроме того, таурин препятствует повышению уровней триглицеридов и холестерина в сыворотке крови. Таурин препятствовал увеличению массы тела и жировой массы у крыс с повышенной калорийностью питания [91].
Эффект таурина на модели метаболического синдрома у крыс, получающих фруктозную диету
Таурин препятствовал развитию гипергликемии и инсулинрезистентности у крыс с ожирением, индуцированным высоким содержанием фруктозы в пище [17, 63–64]. Более того, введение таурина в корм таких крыс приводило к снижению уровня биомаркеров оксидативного стресса (например, продукты перекисного окисления липидов (ПОЛ)). Также было выявлено, что у крыс, получающих фруктозную диету, таурин повышал активность калликреина в моче. Этот эффект подавлялся при одновременном с таурином добавлении в пищу HOE 140 - антагониста B2-рецепторов к брадикинину [60–62]. Таким образом, один из молекулярных механизмов противодействия таурина резистентности к инсулину может заключаться во влиянии кининов на высвобождение инсулина и его активность.
Влияние таурина на секрецию инсулина и чувствительность к инсулину, изученное на модели острой инфузии глюкозы и липидов
Длительное повышение уровня глюкозы в крови связано с резистентностью к инсулину. В то время как 6-часовая инфузия растворов глюкозы высокой концентрации приводила к снижению ее обратного захвата в периферических тканях, одновременная инфузия таурина предупреждала развитие инсулинрезистентности [27]. Кроме того, одновременная инфузия таурина подавляла ПОЛ, индуцированное инфузией растворов глюкозы высокой концентрации в камбаловидную мышцу, что говорит о том, что в противодействии таурина развитию резистентности периферических тканей к инсулину играет роль его антиоксидантная активность. Однако таурин не способен предупредить снижение секреции инсулина, стимулированной введением глюкозы, и повышение содержания активных форм кислорода, индуцированного 48-часовой инфузией растворов глюкозы высокой концентрации [86]. С другой стороны, в некоторых исследованиях было выявлено разностороннее протективное действие таурина, например регуляция кальциевого обмена в митохондриях и стабилизация фолдинга белка на фоне повышенной концентрации глюкозы в культивируемых β-клетках [28, 42].
Ранее был описан благоприятный эффект таурина, оказываемый при дисфункции островков поджелудочной железы, опосредованной действием свободных жирных кислот [69]. Длительная внутривенная инфузия олеата (48 ч) снижает секрецию инсулина, стимулированную глюкозой, а одновременное с этим введениетаурина предупреждает нарушение секреции инсулина β-клетками, индуцируемое олеатом. Кроме того, таурин предупреждает инсулиновую резистентность в печени, вызываемую внутривенной инфузией жирных кислот [96]. Благоприятный эффект таурина сопровождался подавлением окислительного стресса, индуцированного жирными кислотами, и активацией JNK1, нарушающей сигнальные пути инсулина. Эти данные говорят о том, что таурин противодействиует липотоксичности, оказывая протективный эффект на островковые клетки и печень, что, в свою очередь, может способствовать профилактике развития диабета при ожирении.
Эффекты таурина на осложнения сахарного диабета и их молекулярные механизмы
Изменение уровня таурина при сахарном диабете
Известно, что уровень плазменный и тканевой уровни таурина изменяются при различных патофизиологических состояниях. Концентрация плазменного таурина у больных инсулинзависимым СД была значительно снижена по сравнению с пациентами контрольной группы [20–21]. Также было продемонстрировано снижение уровня плазменного таурина у животных со STZ- и аллоксан-индуцированным диабетом [21, 90]. При СД 2-го типа уровень таурина в плазме ниже, чем у пациентов контрольной группы, не страдающих СД [13, 49]. Так как дефицит таурина связан с нарушением функций различных тканей [32, 72, 84], снижение его уровня у больных СД может играть роль в развитии осложнений.
Роль таурина в образовании конечных продуктов гликозилирования и модифицированных ЛПНП
Гипергликемия ускоряет неферментативное гликозилирование белков и приводит к накоплению конечных продуктов гликозилирования. Эти продукты играют ключевую роль в развитии осложнений СД, таких как нефропатия и микроангиопатия. А поскольку таурин по сравнению с другими аминокислотами обладает высокой реактивностью по отношению к альдегидам [68], при СД он может препятствовать образованию конечных продуктов гликозилирования. И действительно, таурин подавлял образование конечных продуктов гликозилирования in vitro [61, 63, 77]. Кроме того, добавление таурина в пищу предупреждало повышение уровня гликозилированных белков (фруктозамин и гликозилированный гемоглобин) у крыс на диете с высоким содержанием фруктозы [63].
Поскольку модифицированные ЛПНП способствуют развитию сосудистых осложнений, таурин, по-видимому, препятствует их модификации. В частности, высокая реактивность таурина по отношению к альдегидам может препятствовать модификации ЛПНП малоновым диальдегидом [68]. Кроме того, таурин снижает уровень гипохлористой кислоты (HClO) (образуется под действием миелопероксидазы нейтрофилов и макрофагов), обладающей противомикробными свойствами и также участвующей в окислении ЛПНП [71]. В эксперименте на крысах с моделью СД 2-го типа была выявлена высокая миелопероксидазная активность в сосудистой стенке [105], что говорит о возможной роли HClO в повышении уровня окисленных ЛПНП при СД. Кроме того, подавление таурином синтеза холестерина ЛПНП само по себе может способствовать ослаблению процессов окисления ЛПНП [8, 24, 57, 100]. К примеру, повышенный уровень холестерина ЛПНП в сыворотке крови мышей со стрептозоциновым диабетом снижался до нормальных значений при регулярном введении таурина [51, 59].
Эндотелиальная дисфункция
Большинство осложнений СД связано с поражением сосудов. Микроангиопатия приводит к ретинопатии, нефропатии и нейропатии, в то время как макроангиопатия приводит к кардиомиопатии и атеросклерозу. На модели стрептозоцинового диабета у мышей было показано, что постоянное кормление мышей тауриновыми добавками приводило к нормализации ацетилхолин-опосредованной релаксации кольцевидных сегментов аорты. [41]. Кроме того, преинкубация тканей с таурином в течение 2 ч ex vivo предупреждало как усиленный ответ на норадреналин так и ослабленный ответ на ацтилхолин в отношении кольца аорты крыс со стрептозоциновым диабетом [1]. Эти данные иллюстрируют протективный эффект таурина при нарушенной эндотелийзависимой вазодилатации во время гипергликемии.
В основе протективного действия таурина при дисфункции эндотелия при СД лежит целых ряд молекулярных механизмов (рис. 1). Как было упомянуто выше, тауринопосредованное снижение уровня конечных продуктов гликозилирования и модифицированных ЛПНП может быть одним из звеньев протективного действия таурина. Также таурин повышает биодоступность оксида азота, снижая концентрацию HClO, которая потребляет оксид азота, предупреждая вазоконстрикцию и дисфункцию эндотелия [71]. Кроме того, таурин подавляет экспрессию молекул адгезии сосудистого эндотелия (VCAM-1) и молекул межклеточной адгезии (ICAM-1), индуцируемую высокой концентрацией глюкозы в культуре эндотелиальных клеток [92]. Добавление таурина в пищу после развития сахарного стрептозоцинового диабета у крыс предотвращало индукцию ICAM-1 и лектиноподобных рецепторов окисленных ЛПНП (LOX-1), ответственных за захват окисленных ЛПНП клетками стенки аорты [94]. Кроме того, поскольку острая гликемия, индуцированная внутривенной инфузией глюкозы, активирует адгезию лейкоцитов и миграцию их в эндотелий, а также повышает экспрессию ICAM-1 и активирует апоптоз у крыс, добавление таурина к пище животных в течение 5 дней перед проведением эксперимента предотвращало реакцию со стороны лейкоцитов и предупреждало повышение секреции ICAM-1 и активацию апоптоза клеток [10]. Отсюда следует, что таурин может предупреждать взаимодействие между лейкоцитами и эндотелиальными клетками, а также активацию апоптоза эндотелиальных клеток, индуцируемую гипергликемией.
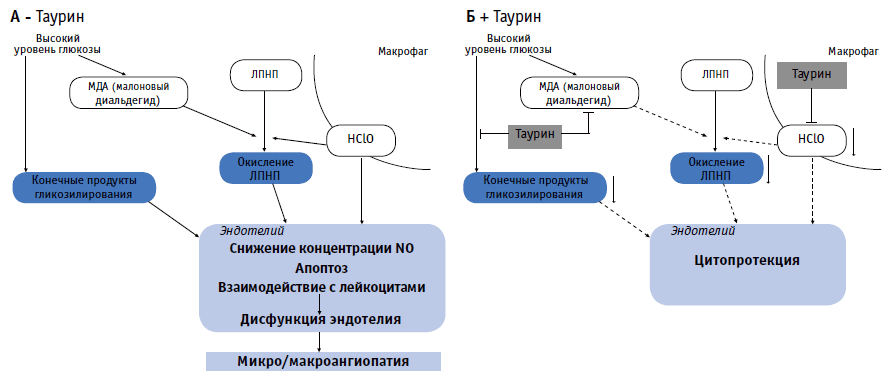 Схематическое изображение возможных путей протективного действия таурина, предупреждающего дисфункцию эндотелия, индуцируемую гипергликемией
Схематическое изображение возможных путей протективного действия таурина, предупреждающего дисфункцию эндотелия, индуцируемую гипергликемией.
Таурин ингибирует:
(i) образование конечных продуктов гликозилирования;
(ii) окисление ЛПНП (oxLDL) за счет уменьшения образования малонового диальдегида и гипохлористой кислоты;
(iii) HClO-зависимое снижение концентрации NO;
(iv) взаимодействие лейкоцитов с эндотелием.
Диабетическая нефропатия
Данные последних исследований показали, что назначение таурина одновременно с инъекцией стрептозоцина снижает альбуминурию, тяжесть течения гломерулосклероза и тубулоинтерстициального фиброза [90]. Недавно было показано, что добавление таурина в корм крыс, начиная с 4-го месяца после индукции у них СД, существенно подавляло повышение экскреции белка с мочой, что было связано с уменьшением разрастания внеклеточного матрикса, экспрессии TGF-β и окислительного стресса в почечных клубочках [34]. В исследованиях in vitro также продемонстрировано, что назначение таурина препятствует усилению перекисного окисления липидов и секреции TGF-β, вызванных высоким уровнем глюкозы в клетках проксимальных почечных канальцев [70]. Кроме того, таурин:
- Снижает нарушенный клеточный рост и гипертрофию клеток почечных канальцев, индуцируемой высоким уровнем глюкозы, что связано с подавлением активации таких сигнальных путей, как MAPK (митогенактивируемый протеинкиназный каскад) и STAT3 (преобразователь сигнала и активатор транскрипции-3) [35];
- ослабляет индукцию цитохрома P450 2E1, принимающего участие в метаболизме различных эндогенных и экзогенных соединений и являющемся потенциальным источником активных форм кислорода (ROS) в почках крыс со стрептозоциновым диабетом [99];
- снижает клеточную гипертрофию и фиброз, индуцируемые конечными продуктами гликозилирования в клетках канальцевого эпителия почек [36];
- подавляет индукцию генов, ассоциированных с фиброзом, в клетках канальцевого эпителия почек (развивается под действием конечных продуктов гликозилирования) [37].
Таким образом, таурин может предотвращать повреждение почки и развитие фиброза у животных с СД путем подавления образования активных форм кислорода, индуцированного высоким уровнем глюкозы и конечных продуктов гликозилирования в почке.
Диабетическая ретинопатия
Добавление таурина к пище крыс с STZ-индуцированным диабетом после развития диабета уменьшало ультраструктурные изменения и ослабляло индукцию глиофибриллярного кислого протеина (GFAP), маркера глиоза, а также подавляло апоптоз в глиальных клетках сетчатки, не влияя на уровень глюкозы в плазме [101–103], что свидетельствует о протективной роли таурина при диабетической ретинопатии. Кроме того, у крыс со стрептозоциновым диабетом добавление таурина приводило к существенному снижению концентрации карбонилдиеновых соединений в сетчатке [14–15] и подавлению индукции фактора роста эндотелия сосудов (VEGF) в сетчатке, что говорит о нормализации функции сосудов сетчатки при СД [67, 102]. Кроме того, повышение уровня глутамата в сетчатке у крыс со стрептозоциновым диабетом способствует развитию диабетической ретинопатии. Таурин же снижает содержание глутамата в сетчатке и повышает синтез белка, принимающего участие в его обратном захвате и разрушении [102]. Соответственно, таурин подавляет нарушение усвоения глутамата и его деградацию, индуцированные высоким уровнем глюкозы в культуре глиальных клеток сетчатки (клетки Мюллера) [104].
Диабетическая катаракта
Как известно, наиболее высокое содержание таурина выявлено в хрусталике глаза. У крыс со стрептозоциновым диабетом при диабетической катаракте этот уровень значительно снижен [3, 48, 93]. Хроническое добавление таурина к пище таких животных приводило к снижению уровня малонового диальдегида в хрусталике глаза [65]. Кроме того, хотя таурин не способствует повышению прозрачности хрусталика (вызываемое повышением уровня глюкозы в культуральной среде в течение 6 дней), он ингибирует карбонилирование белков, индуцируемое высоким уровнем глюкозы [80].
Эти исследования показали, что таурин защищает хрусталик от окислительного стресса, вызываемого гипергликемией, в то время как защитное действие его против катаракты остается дискутабельным.
Диабетическая невропатия
Известно, что накопление сорбитола в нерве способствует развитию периферической невропатии при СД. При повышенном содержании внутриклеточной глюкозы ее избыток в результате метаболических реакций с участием альдоредуктазы превращается в сорбитол. Регуляция уровня органических осмолитов, включая сорбитол, таурин и мио-инозитол, осуществляется в соответствии с изменениями осмолярности внеклеточной жидкости и поддерживает постоянный клеточный объем. Stevens показал, что при стрептозоциновом СД у крыс уровни таурина и мио-инозитола в нервах снижены, но введение ингибиторов альдоредуктазы препятствует истощению запасов таурина и миоинозитола [82]. Это говорит о том, что накопление сорбитола приводит к снижению содержания других органических осмолитов. Примечательно, что высокий уровень глюкозы в клетках подавляет экспрессию белка – переносчика таурина, в то время как введение ингибитора альдоредуктазы или антиоксидантов вместе с глюкозой восстанавливает его активность [5, 83], что свидетельствует о чрезвычайно важной роли сорбитола в регуляции концентрации внутриклеточного таурина. На модели невропатии у крыс со стрептозоциновым диабетом таурин улучшал нарушенную функцию нервов, в частности повышая проведение возбуждения и устраняя гиперальгезию, а также улучшая кровоснабжение нерва [46, 66–67, 73, 82].
Таурин ослабляет окислительный стресс в нервах и препятствует нарушению кальциевого обмена в сенсорных нейронах у крыс со стрептозоциновым диабетом [46]. Кроме того, таурин предотвращает снижение уровня фактора роста нервов (NGF) при стрептозоциновом диабете у крыс [66]. Аналогичные данные приводят Li с соавт. [47], показавшие на модели крыс с СД и ожирением (Zucker diabetic fatty rats) эффективность таурина при периферической диабетической невропатии (улучшение проведения по двигательным волокнам седалищного нерва и пальцевым чувствительным нервам, увеличение кровотока в нерве).
Атеросклероз и тромбоз
СД является серьезнейшим фактором риска развития атеросклероза. По некоторым данным, таурин оказывает благоприятный эффект на течение атеросклероза [44, 53–55], однако на моделях СД это доказано не было. Так как эндотелиальная дисфункция и накопление окисленных форм ЛПНП в сосудах являются пусковыми звеньями в развитии атеросклероза, можно предположить, что различные эффекты таурина на эндотелиальные клетки, описанные выше (снижение уровня окисленных ЛПНП и подавление апоптоза) могут помочь предупредить атеросклероз при СД.
Активация тромбоцитов и их агрегация при атеросклерозе – основные звенья в развития тромбоза. Известно, что при СД функция тромбоцитов нарушена, что способствует развитию тромбоза под действием стрессорных факторов. Имеются данные о том, что уровень таурина как в тромбоцитах, так и в плазме крови у больных СД типов 1 и 2 снижен [13, 20]. А поскольку истощение запасов таурина повышает склонность тромбоцитов к агрегации [33], было высказано предположение о том, что его назначение больным СД может предупреждать тромбообразование. По данным Franconi и др. [20], прием таурина в дозе 1,5 г/сут в течение 90 дней больными инсулинзависимым СД подавлял агрегацию изолированных тромбоцитов, индуцированную арахидоновой кислотой. Кроме того, эти авторы показали, что предварительная инкубация тромбоцитов с таурином ингибирует агрегацию тромбоцитов, индуцируемую арахидоновой кислотой, у больных СД.
Диабетическая кардиомиопатия
В отличие от других тканей, в сердечной мышце у крыс со стрептозоциновым диабетом уровень таурина повышен, а у крыс с диабетом, ассоциированным с ожирением, он не меняется [50]. Повышение уровня таурина в сердечной мышце было выявлено как в эксперименте, так и у больных с сердечной недостаточностью и, по-видимому, является проявлением кардиомиопатии [39]. Биологическое значение повышенного уровня таурина при сердечной недостаточности пока не ясно, однако следует полагать, что при диабетической кардиомиопатии он модулирует гликолитическую способность, в частности фосфорилирование пируватдегидрогеназы [50]. Li с соавторами [45] получили данные о том, что таурин, добавляемый в пищу после развития кардиомиопатии, предупреждает увеличение массы сердца и улучшает диастолическую (-dp/dt max), но не систолическую (+dp/dt max) функцию миокарда. Кроме того, добавление таурина в пищу препятствует снижению экспрессии гена Bcl-2 на модели диабетической кардиомиопатии у крыс со стрептозоциновым диабетом, что говорит о возможном подавлении апоптоза таурином и его протективном действии при диабетической кардиомиопатии.
Клинические исследования
В ряде клинических исследований была изучена эффективность таурина при СД (табл. 1). В частности, Elizarova и Nedosugova в 1996 г. [18] провели исследование влияния таурина на гипергликемию у больных СД 1-го типа (n=10), получавших инъекции инсулина в качестве терапии. Таурин (0,5 г 2 раза в сут) улучшал метаболизм углеводов и снижал уровень триглицеридов. Однако в другом исследовании [20] прием таурина в дозе 1,5 г/сут в течение 90 дней не повлиял на метаболизм глюкозы у больных инсулинзависимым диабетом (n=39). Таким образом, целесообразность применения таурина в клинике при СД 1-го типа пока окончательно не установлена.
Таблица 1. Назначение таурина при сахарном диабете и его осложнениях
| Статья | Тема | Длительность | Доза (в сут) | Конечная точка | Результат |
| Сахарный диабет |
Franconi et al.
(1995) | Больные инсулинзависимым диабетом (n=39) | 90 дней | 1,5 г | Метаболизм глюкозы | НД |
Elizarova,
Nedosugova (1996) | Больные инсулинзависимым диабетом (n=10) | 30 дней | 1 г | Метаболизм глюкозы | Улучшает |
| Триглицериды | Снижает |
Chauncey et al.
(2003) | Больные инсулиннезависимым диабетом (n=32) | 4 мес | 3 г | HbA1c | НД |
| Уровень перекисного окисления липидов в плазме | НД |
| Brons et al. (2004) | Мужчины с избыточной массой тела, не страдающие сахарным диабетом (n=20) | 8 нед | 1,5 г | Секреция инсулина | НД |
| Уровень липидов в плазме | НД |
| Xiao et al. (2008) | Мужчины с избыточной массой тела, не страдающие сахарным диабетом(п=6) | 2 нед | 3 г | Нарушение чувствительности к инсулину при 48-часовой внутривенной инфузии липидов | Улучшает |
| Продукты перекисного окисления липидов | Снижает |
| Осложнения |
| Nakamura et al. (1999) | Больные инсулиннезависимым сахарным диабетом с микроальбуминемией (n=10 в каждой группе) | 12 мес | 3 г | Микроальбуминемия | НД |
| Биомаркеры фиброза | НД |
| Moloney et al. (2010) | Инсулинзависимый сахарный диабет(п=9) | 2 нед | 1,5 г | Гипергликемия | НД |
| Эндотелийзависимая реакция | Улучшает |
Опубликовано несколько сообщений о результатах лечения таурином больных СД 2. Chauncey с соавт. [12] изучили гипогликемический эффект таурина при назначении его больным СД 2 (n=32) и показали, что при его назначение в дозе 3 г/сут в течение 4 мес повышало уровень таурина в плазме, но не меняло уровень гликозилированного гемоглобина HbA1c в плазме крови и не влияло на ПОЛ при сравнении данных с контрольной группой, получавшей плацебо.
Brons с соавторами [9] в перекрестном исследовании изучили эффект таурина на мужчинах, страдающих СД, ассоциированным с ожирением (n=20). И хотя уровень таурина в плазме крови после его приема в дозе 1,5 г/сут в течение 8 нед повышался, таурин не оказывал влияния ни на секрецию инсулина, ни на уровень липидов в плазме крови. Эти исследования показали, что таурин, вопреки результатам экспериментов, не влияет на гипергликемию и резистентность к инсулину у больных СД 2. Однако следует отметить, что эти клинические исследования имеют определенные недостатки. К примеру, больным, помимо таурина, назначались и другие препараты. Также наблюдали различия в принимаемых дозах таурина, длительности наблюдений и др. С другой стороны, в перекрестном исследовании Xiao с соавт. [97] получили данные о том, что таурин эффективен при сниженной чувствительности к инсулину. Они продемонстрировали эффект таурина у мужчин с избыточной массой тела или ожирением, не страдающих СД (n=6), при хроническом повышении концентрации жирных кислот в плазме крови, вызванном внутривенной инфузией Интралипида (20% соевое масло, 1,2% фосфолипиды яичных желтков, 2,25% водный раствор глицерина, гепарин). Длительная внутривенная инфузия (48 ч) липидов вызывала резистентность к инсулину, в то время как назначение таурина в дозе 3 г/сут в течение 2 нед до инфузии липидов повышало сниженную чувствительность к инсулину и предупреждало повышение содержания продуктов ПОЛ в плазме крови. Эти данные свидетельствуют о том, что назначение пациентам таурина внутрь снижает резистентность к инсулину, индуцируемую инфузией жирных кислот, что, по-видимому, обусловлено снижением окислительного стресса.
Что касается диабетической нефропатии, то Nakamura c соавторами [56] изучили влияние тауриновых добавок (3 г/сут) на пациентов с микроальбуминемией при СД 2. Терапия проводилась в течение 12 мес в совместном исследовании (n=10 в каждой группе). Авторы показали, что тауриновые добавки неэффективны при микроальбуминемии и не снижают уровня таких биомаркеров фиброза, как коллаген IV типа и матричная металлопротеиназа-9.
Moloney и соавт. (2010) выявили благоприятный эффект таурина при дисфункции эндотелия у больных СД 1 (перекрестное исследование). В то время как ригидность артериальной стенки и расширение плечевой артерии, вызванное увеличением кровотока (показатели, зависящие от реакции эндотелия), у больных СД были снижены по сравнению со здоровыми людьми. Прием таурина в дозе 1,5 г/сут в течение 2 нед восстанавливал эти показатели до уровня, отмечавшегося в контрольной группе пациентов, не оказывая гипогликемического эффекта. Эти данные говорят о протективном действии таурина на эндотелий. Примечательно, что те же авторы ранее сообщили об улучшении со стороны нарушенной дилатации артерий, наблюдаемом в ответ на повышение кровотока у молодых курильщиков при приеме таурина в дозе 1,5 г/сут в течение 2 нед [19]. Кроме того, в то время как кондиционирование культуральной среды моноцитами, взятыми у курильщиков, подавляло высвобождение оксида азота и восстанавливало концентрацию эндотелина-1 до контрольного уровня в эндотелиальных клетках пупочной вены человека (HUVEC), кондиционирование культуральной среды моноцитами, взятыми у курильщиков, принимавших таурин, восстановливало до контрольного уровня концентрации оксида азота и эндотелина-1. Следовательно, можно полагать, что подавление взаимодействия между моноцитами и эндотелием является ключевым звеном в механизме протективного действия таурина на функции эндотелия. А учитывая роль взаимодействия моноцитов и эндотелия в развитии дисфункции эндотелия на модели СД у животных, возможно, оно лежит в основе противодействия таурина развитию дисфункции эндотелия у больных СД.
Обсуждение
Многочисленные исследования, проведенные на экспериментальных моделях СД, показали, что прием таурина оказывает благоприятное действие на течение СД и его осложнений. Более того, таурин, оказывая разностороннее действие, препятствует развитию как самого СД, так и его осложнений (табл. 2). В частности, подавление таурином окислительного стресса лежит в основе различных механизмов его действия на течение СД. Во-первых, способность таурина быстро вступать в реакцию с альдегидом способствует снижению концентрации конечных продуктов гликозилирования и модификации ЛПНП. Во-вторых, снижая содержание HClO, он подавляет модификацию ЛПНП и повышает биодоступность NO. Наконец, таурин ингибирует образование активных форм кислорода, регулируя функцию митохондрий [76]. Предложено несколько объяснений повышенной концентрации таурина в митохондриях. Ученые обнаружили в митохондриальной транспортной РНК (тРНК) тауринсодержащий модифицированный уридин [85]. Таурин-модифицированная тРНК, по-видимому, играет ключевую роль в трансляции белков, ответственных за транспорт электронов [43], поэтому можно предположить, что истощение запасов таурина может привести к снижению содержания таурин-модифицированной тРНК и нарушению транспорта электронов. Имеются данные о буферных свойствах таурина в митохондриальном матриксе [30]. Следовательно, истощение запасов таурина при СД способствует развитию митохондриальной дисфункции, а восстановление его уровня, напротив, может способствовать нормализации их функции, что связано с подавлением образования активных форм кислорода в митохондриях. Для изучения роли истощения запасов таурина в нарушении функции митохондрий и развитии осложнений СД, потребуется проведение дальнейших исследований, в том числе экспериментов на животных с нокаутом белка – переносчика таурина [40].
Таблица 2. Молекулярные механизмы благоприятного эффекта таурина при осложнениях сахарного диабета
| Осложнения сахарного диабета | Действие таурина |
| Дисфункция эндотелия |
Препятствует образованию конечных продуктов гликозилирования
Уменьшает содержание альдегидов → окисленные ЛПНП ↓
Уменьшает содержание HClO → окисленные ЛПНП ↓, NO ↑
Холестерин ЛПНП ↓
Подавляет апоптоз эндотелиальных клеток
Предотвращает ↑ VCAM-1, ICAM-1 → взаимодействие лейкоцитов и эндотелия ↓
|
| Диабетическая нефропатия |
TGF-β ↓ → предупреждает фиброз
Подавляет каскад MAPK, STAT3 → рост клеток
Цитохром P450 2E1 ↓ → окислительный стресс ↓
|
| Диабетическая ретинопатия |
Окислительный стресс ↓ → предотвращение ↓ активности Na+/K+-ATPазы
Предупреждает ↑ VEGF → функция сосудов сетчатки
|
| Диабетическая катаракта |
Окислительный стресс ↓
Предупреждает карбонилирование белков
|
| Диабетическая невропатия |
Окислительный стресс ↓ в нервной ткани
Препятствует нарушению обмена кальция в чувствительных нейронах
Подавление NGF ↓
|
| Диабетическая кардиомиопатия |
Подавляет Bcl-2 ↓ → апоптоз ↓
|
Несмотря на данные об эффективности лечения таурином СД, в целом ряде клинических исследований не удалось показать благоприятного эффекта таурина на резистентность к инсулину и течение осложнений СД. Несоответствие результатов клинических исследований и экспериментальных данных может быть связано с рядом недостатков в проведении клинических исследований, в частности с неоднородностью выборки по тяжести заболевания, препаратам, принимаемых больными, их дозе, длительности исследования и т.д. Важно также, что доза таурина на единицу массы тела экспериментального животного, получавшего, к примеру, диету с 5% таурина, в 10 раз и более превосходит дозу, назначаемую в клинических условиях (1,5–3 г таурина в сут).
Авторы полагают, что тауриновые добавки опасны не более чем аминокислотные. Полученные ранее данные доказали, что его прием в дозировке до 3 г/сут безопасен, при этом ряд клинических исследований показал, что препарат можно принимать без опасений и в больших дозах [6–7, 78].
Хотя таурин оказывает мягкое фармакологическое действие, нет достоверных данных о безопасности его назначения в сочетании с другими препаратами. Клинические исследования, проведенные к настоящему времени, включают лишь небольшое число больных. Следовательно, необходимо проведение более крупных исследований для изучения эффективности таурина при лечении СД и его осложнений. Не стоит забывать и о том, что на результаты исследования влияет образ жизни (в частности генетические факторы) и генетический полиморфизм, обусловливающий индивидуальные различия. Известно, что концентрация таурина в моче у человека подвержена значительным индивидуальным колебаниям [98] Brons с соавт. [9] сообщали о значительной вариабельности повышения уровня концентрации таурина в плазме при его приеме. Такая индивидуальная вариабельность может быть связана не только с образом жизни, но и с геномным полиморфизмом генов, кодирующих таурин, ассоциированных с ним белков (например белком – переносчиком таурина). Поэтому авторы полагают, что выявление генетических факторов, влияющих на обмен таурина, поможет пролить свет на механизмы лечебного действия таурина при терапии СД и его осложнений.
Сведения о ведущем авторе
Юничи Азума (J. Azuma) – профессор клинической фармакогеномики, директор фармацевтической школы медицинского университета Хёго, Япония.
Литература
- Abebe W. Effects of taurine on the reactivity of aortas from diabetic rats. Life Sci. 2008;82:279–289. [PubMed]
- Alvarado-Vasquez N, Zamudio P, Ceron E, Vanda B, Zenteno E, Carvajal-Sandoval G. Effect of glycine in streptozotocin-induced diabetic rats. Comp Biochem Physiol C Toxicol Pharmacol. 2003;134:521–527. [PubMed]
- Anthrayose CV, Shashidhar S. Studies on protein and taurine in normal, senile and diabetic cataractous human lenses. Indian J Physiol Pharmacol. 2004;48:357–360. [PubMed]
- Arany E, Strutt B, Romanus P, Remacle C, Reusens B, Hill DJ. Taurine supplement in early life altered islet morphology, decreased insulitis and delayed the onset of diabetes in non-obese diabetic mice. Diabetologia. 2004;47:1831–1837. [PubMed]
- Askwith T, Zeng W, Eggo MC, Stevens MJ. Oxidative stress and dysregulation of the taurine transporter in high-glucose- exposed human Schwann cells: implications for pathogenesis of diabetic neuropathy. Am J Physiol Endocrinol Metab. 2009;297:E620–E628. [PubMed]
- Azuma J, Hasegawa H, Sawamura A, Awata N, Ogura K, Harada H, Yamamura Y, Kishimoto S. Therapy of congestive heart failure with orally administered taurine. Clin Ther. 1983;5:398–408. [PubMed]
- Azuma J, Sawamura A, Awata N, Ohta H, Hamaguchi T, Harada H, Takihara K, Hasegawa H, Yamagami T, Ishiyama T, et al. Therapeutic effect of taurine in congestive heart failure: a double-blind crossover trial. Clin Cardiol. 1985;8:276–282. [PubMed]
- Bellentani S, Pecorari M, Cordoma P, Marchegiano P, Manenti F, Bosisio E, Fabiani E, Galli G. Taurine increases bile acid pool size and reduces bile saturation index in the hamster. J Lipid Res. 1987;28:1021–1027. [PubMed]
- Brons C, Spohr C, Storgaard H, Dyerberg J, Vaag A. Effect of taurine treatment on insulin secretion and action, and on serum lipid levels in overweight men with a genetic predisposition for type II diabetes mellitus. Eur J Clin Nutr. 2004;58:1239–1247. [PubMed]
- Casey RG, Gang C, Joyce M, Bouchier-Hayes DJ. Taurine attenuates acute hyperglycaemia-induced endothelial cell apoptosis, leucocyte-endothelial cell interactions and cardiac dysfunction. J Vasc Res. 2007;44:31–39. [PubMed]
- Chang KJ, Kwon W. Immunohistochemical localization of insulin in pancreatic beta-cells of taurine-supplemented or taurine-depleted diabetic rats. Adv Exp Med Biol. 2000;483:579–587. [PubMed]
- Chauncey KB, Tenner TE, Jr, Lombardini JB, Jones BG, Brooks ML, Warner RD, Davis RL, Ragain RM. The effect of taurine supplementation on patients with type 2 diabetes mellitus. Adv Exp Med Biol. 2003;526:91–96. [PubMed]
- Luca G, Calpona PR, Caponetti A, Romano G, Di Benedetto A, Cucinotta D, Di Giorgio RM. Taurine and osmoregulation: platelet taurine content, uptake, and release in type 2 diabetic patients. Metabolism. 2001;50:60–64. [PubMed]
- Di Leo MA, Santini SA, Cercone S, Lepore D, Gentiloni Silveri N, Caputo S, Greco AV, Giardina B, Franconi F, Ghirlanda G. Chronic taurine supplementation ameliorates oxidative stress and Na+ K+ ATPase impairment in the retina of diabetic rats. Amino Acids. 2002;23:401–406. [PubMed]
- Di Leo MA, Ghirlanda G, Gentiloni Silveri N, Giardina B, Franconi F, Santini SA. Potential therapeutic effect of antioxidants in experimental diabetic retina: a comparison between chronic taurine and vitamin E plus selenium supplementations. Free Radic Res. 2003;37:323–330. [PubMed]
- Di Leo MA, Santini SA, Gentiloni Silveri N, Giardina B, Franconi F, Ghirlanda G. Long-term taurine supplementation reduces mortality rate in streptozotocin-induced diabetic rats. Amino Acids. 2004;27:187–191. [PubMed]
- El Mesallamy HO, El-Demerdash E, Hammad LN, El Magdoub HM. Effect of taurine supplementation on hyperhomocysteinemia and markers of oxidative stress in high fructose diet induced insulin resistance. Diabetol Metab Syndr. 2010;2(46):46. [PMC free article] [PubMed]
- Elizarova EP, Nedosugova LV. First experiments in taurine administration for diabetes mellitus. The effect on erythrocyte membranes. Adv Exp Med Biol. 1996;403:583–588. [PubMed]
- Fennessy FM, Moneley DS, Wang JH, Kelly CJ, Bouchier-Hayes DJ. Taurine and vitamin C modify monocyte and endothelial dysfunction in young smokers. Circulation. 2003;107:410–415. [PubMed]
- Franconi F, Bennardini F, Mattana A, Miceli M, Ciuti M, Mian M, Gironi A, Anichini R, Seghieri G. Plasma and platelet taurine are reduced in subjects with insulin-dependent diabetes mellitus: effects of taurine supplementation. Am J Clin Nutr. 1995;61:1115–1119. [PubMed]
- Franconi F, Miceli M, Fazzini A, Seghieri G, Caputo S, DiLeo MA, Lepore D, Ghirlanda G. Taurine and diabetes. Humans and experimental models. Adv Exp Med Biol. 1996;403:579–582. [PubMed]
- Franconi F, Di Leo MA, Bennardini F, Ghirlanda G. Is taurine beneficial in reducing risk factors for diabetes mellitus? Neurochem Res. 2004;29:143–150. [PubMed]
- Franconi F, Loizzo A, Ghirlanda G, Seghieri G. Taurine supplementation and diabetes mellitus. Curr Opin Clin Nutr Metab Care. 2006;9:32–36. [PubMed]
- Gandhi VM, Cherian KM, Mulky MJ. Hypolipidemic action of taurine in rats. Indian J Exp Biol. 1992;30:413–417. [PubMed]
- Gavrovskaya LK, Ryzhova OV, Safonova AF, Matveev AK, Sapronov NS. Protective effect of taurine on rats with experimental insulin-dependent diabetes mellitus. Bull Exp Biol Med. 2008;146:226–228. [PubMed]
- Goodman HO, Shihabi ZK. Supplemental taurine in diabetic rats: effects on plasma glucose and triglycerides. Biochem Med Metab Biol. 1990;43:1–9. [PubMed]
- Haber CA, Lam TK, Yu Z, Gupta N, Goh T, Bogdanovic E, Giacca A, Fantus IG. N-acetylcysteine (NAC) and taurine prevent hyperglycemia-induced insulin resistance in vivo: possible role of oxidative stress. Am J Physiol Endocrinol Metab. 2003;285:E744–E753. [PubMed]
- Han J, Bae JH, Kim SY, Lee HY, Jang BC, Lee IK, Cho CH, Lim JG, Suh SI, Kwon TK, et al. Taurine increases glucose sensitivity of UCP2-overexpressing beta-cells by ameliorating mitochondrial metabolism. Am J Physiol Endocrinol Metab. 2004;287:E1008–E1018. [PubMed]
- Hansen SH. The role of taurine in diabetes and the development of diabetic complications. Diabetes Metab Res Rev. 2001;17:330–346. [PubMed]
- Hansen SH, Andersen ML, Cornett C, Gradinaru R, Grunnet N. A role for taurine in mitochondrial function. J Biomed Sci. 2010;17(Suppl 1):S23. [PMC free article] [PubMed]
- Harada N, Ninomiya C, Osako Y, Morishima M, Mawatari K, Takahashi A, Nakaya Y. Taurine alters respiratory gas exchange and nutrient metabolism in type 2 diabetic rats. Obes Res. 2004;12:1077–1084. [PubMed]
- Hayes KC, Carey RE, Schmidt SY. Retinal degeneration associated with taurine deficiency in the cat. Science. 1975;188:949–951. [PubMed]
- Hayes KC, Pronczuk A, Addesa AE, Stephan ZF. Taurine modulates platelet aggregation in cats and humans. Am J Clin Nutr. 1989;49:1211–1216. [PubMed]
- Higo S, Miyata S, Jiang QY, Kitazawa R, Kitazawa S, Kasuga M. Taurine administration after appearance of proteinuria retards progression of diabetic nephropathy in rats. Kobe J Med Sci. 2008;54:E35–E45. [PubMed]
- Huang JS, Chuang LY, Guh JY, Huang YJ, Hsu MS. Antioxidants attenuate high glucose-induced hypertrophic growth in renal tubular epithelial cells. Am J Physiol Renal Physiol. 2007;293:F1072–F1082. [PubMed]
- Huang JS, Chuang LY, Guh JY, Yang YL, Hsu MS. Effect of taurine on advanced glycation end products-induced hypertrophy in renal tubular epithelial cells. Toxicol Appl Pharmacol. 2008;233:220–226. [PubMed]
- Huang JS, Chuang LY, Guh JY, Huang YJ. Effects of nitric oxide and antioxidants on advanced glycation end products-induced hypertrophic growth in human renal tubular cells. Toxicol Sci. 2009;111(1):109–119. [PubMed]
- Huxtable RJ. Physiological actions of taurine. Physiol Rev. 1992;72:101–163. [PubMed]
- Huxtable R, Bressler R. Taurine concentrations in congestive heart failure. Science. 1974;184:1187–1188. [PubMed]
- Ito T, Kimura Y, Uozumi Y, Takai M, Muraoka S, Matsuda T, Ueki K, Yoshiyama M, Ikawa M, Okabe M, Schaffer SW, Fujio Y, Azuma J. Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy. J Mol Cell Cardiol. 2008;44:927–937. [PubMed]
- Kamata K, Sugiura M, Kojima S, Kasuya Y. Restoration of endothelium-dependent relaxation in both hypercholesterolemia and diabetes by chronic taurine. Eur J Pharmacol. 1996;303:47–53. [PubMed]
- Kaniuk NA, Kiraly M, Bates H, Vranic M, Volchuk A, Brumell JH. Ubiquitinated-protein aggregates form in pancreatic beta-cells during diabetes-induced oxidative stress and are regulated by autophagy. Diabetes. 2007;56:930–939. [PubMed]
- Kirino Y, Yasukawa T, Ohta S, Akira S, Ishihara K, Watanabe K, Suzuki T. Codon-specific translational defect caused by a wobble modification deficiency in mutant tRNA from a human mitochondrial disease. Proc Natl Acad Sci USA. 2004;101:15070–15075. [PMC free article] [PubMed]
- Kondo Y, Murakami S, Oda H, Nagate T. Taurine reduces atherosclerotic lesion development in apolipoprotein E-deficient mice. Adv Exp Med Biol. 2000;483:193–202. [PubMed]
- Li C, Cao L, Zeng Q, Liu X, Zhang Y, Dai T, Hu D, Huang K, Wang Y, Wang X, et al. Taurine may prevent diabetic rats from developing cardiomyopathy also by downregulating angiotensin II type2 receptor expression. Cardiovasc Drugs Ther. 2005;19:105–112. [PubMed]
- Li F, Obrosova IG, Abatan O, Tian D, Larkin D, Stuenkel EL, Stevens MJ. Taurine replacement attenuates hyperalgesia and abnormal calcium signaling in sensory neurons of STZ-D rats. Am J Physiol Endocrinol Metab. 2005;288:E29–E36. [PubMed]
- Li F, Abatan OI, Kim H, Burnett D, Larkin D, Obrosova IG, Stevens MJ. Taurine reverses neurological and neurovascular deficits in Zucker diabetic fatty rats. Neurobiol Dis. 2006;22:669–676. [PubMed]
- Malone JI, Lowitt S, Cook WR. Nonosmotic diabetic cataracts. Pediatr Res. 1990;27:293–296. [PubMed]
- Merheb M, Daher RT, Nasrallah M, Sabra R, Ziyadeh FN, Barada K. Taurine intestinal absorption and renal excretion test in diabetic patients: a pilot study. Diabetes Care. 2007;30:2652–2654. [PubMed]
- Militante JD, Lombardini JB, Schaffer SW. The role of taurine in the pathogenesis of the cardiomyopathy of insulin-dependent diabetes mellitus. Cardiovasc Res. 2000;46:393–402. [PubMed]
- Mochizuki H, Takido J, Oda H, Yokogoshi H. Improving effect of dietary taurine on marked hypercholesterolemia induced by a high-cholesterol diet in streptozotocin-induced diabetic rats. Biosci Biotechnol Biochem. 1999;63:1984–1987. [PubMed]
- Moloney MA, Casey RG, O’Donnell DH, Fitzgerald P, Thompson C, Bouchier-Hayes DJ. Two weeks taurine supplementation reverses endothelial dysfunction in young male type 1 diabetics. Diab Vasc Dis Res. 2010;7:300–310. [PubMed]
- Murakami S, Kondo Y, Tomisawa K, Nagate T. Prevention of atherosclerotic lesion development in mice by taurine. Drugs Exp Clin Res. 1999;25:227–234. [PubMed]
- Murakami S, Kondo-Ohta Y, Tomisawa K. Improvement in cholesterol metabolism in mice given chronic treatment of taurine and fed a high-fat diet. Life Sci. 1999;64:83–91. [PubMed]
- Murakami S, Kondo Y, Sakurai T, Kitajima H, Nagate T. Taurine suppresses development of atherosclerosis in Watanabe heritable hyperlipidemic (WHHL) rabbits. Atherosclerosis. 2002;163:79–87. [PubMed]
- Nakamura T, Ushiyama C, Suzuki S, Shimada N, Ohmuro H, Ebihara I, Koide H. Effects of taurine and vitamin E on microalbuminuria, plasma metalloproteinase-9, and serum type IV collagen concentrations in patients with diabetic nephropathy. Nephron. 1999;83:361–362. [PubMed]
- Nakamura-Yamanaka Y, Tsuji K, Ichikawa T. Effect of dietary taurine on cholesterol 7 alpha-hydroxylase activity in the liver of mice fed a lithogenic diet. J Nutr Sci Vitaminol (Tokyo) 1987;33:239–243. [PubMed]
- Nakaya Y, Minami A, Harada N, Sakamoto S, Niwa Y, Ohnaka M. Taurine improves insulin sensitivity in the Otsuka Long-Evans Tokushima Fatty rat, a model of spontaneous type 2 diabetes. Am J Clin Nutr. 2000;71:54–58. [PubMed]
- Nanami K, Oda H, Yokogoshi H. Antihypercholesterolemic action of taurine on streptozotocin-diabetic rats or on rats fed a high cholesterol diet. Adv Exp Med Biol. 1996;403:561–568. [PubMed]
- Nandhini AT, Anuradha CV. Taurine modulates kallikrein activity and glucose metabolism in insulin resistant rats. Amino Acids. 2002;22:27–38. [PubMed]
- Nandhini TA, Anuradha CV. Inhibition of lipid peroxidation, protein glycation and elevation of membrane ion pump activity by taurine in RBC exposed to high glucose. Clin Chim Acta. 2003;336:129–135. [PubMed]
- Nandhini AT, Anuradha CV. Hoe 140 abolishes the blood pressure lowering effect of taurine in high fructose-fed rats. Amino Acids. 2004;26:299–303. [PubMed]
- Nandhini AT, Thirunavukkarasu V, Anuradha CV. Stimulation of glucose utilization and inhibition of protein glycation and AGE products by taurine. Acta Physiol Scand. 2004;181:297–303. [PubMed]
- Nandhini AT, Thirunavukkarasu V, Ravichandran MK, Anuradha CV. Effect of taurine on biomarkers of oxidative stress in tissues of fructose-fed insulin-resistant rats. Singapore Med J. 2005;46:82–87. [PubMed]
- Obrosova IG, Stevens MJ. Effect of dietary taurine supplementation on GSH and NAD(P)-redox status, lipid peroxidation, and energy metabolism in diabetic precataractous lens. Invest Ophthalmol Vis Sci. 1999;40:680–688. [PubMed]
- Obrosova IG, Fathallah L, Stevens MJ. Taurine counteracts oxidative stress and nerve growth factor deficit in early experimental diabetic neuropathy. Exp Neurol. 2001;172:211–219. [PubMed]
- Obrosova IG, Minchenko AG, Marinescu V, Fathallah L, Kennedy A, Stockert CM, Frank RN, Stevens MJ. Antioxidants attenuate early up regulation of retinal vascular endothelial growth factor in streptozotocin-diabetic rats. Diabetologia. 2001;44:1102–1110. [PubMed]
- Ogasawara M, Nakamura T, Koyama I, Nemoto M, Yoshida T. Reactivity of taurine with aldehydes and its physiological role. Chem Pharm Bull (Tokyo) 1993;41:2172–2175. [PubMed]
- Oprescu AI, Bikopoulos G, Naassan A, Allister EM, Tang C, Park E, Uchino H, Lewis GF, Fantus IG, Rozakis-Adcock M, et al. Free fatty acid-induced reduction in glucose-stimulated insulin secretion: evidence for a role of oxidative stress in vitro and in vivo. Diabetes. 2007;56:2927–2937. [PubMed]
- Park SH, Choi HJ, Lee JH, Woo CH, Kim JH, Han HJ. High glucose inhibits renal proximal tubule cell proliferation and involves PKC, oxidative stress, and TGF-beta 1. Kidney Int. 2001;59:1695–1705. [PubMed]
- Pennathur S, Heinecke JW. Oxidative stress and endothelial dysfunction in vascular disease. Curr Diab Rep. 2007;7:257–264. [PubMed]
- Pion PD, Kittleson MD, Rogers QR, Morris JG. Myocardial failure in cats associated with low plasma taurine: a reversible cardiomyopathy. Science. 1987;237:764–768. [PubMed]
- Pop-Busui R, Sullivan KA, Huysen C, Bayer L, Cao X, Towns R, Stevens MJ. Depletion of taurine in experimental diabetic neuropathy: implications for nerve metabolic, vascular, and functional deficits. Exp Neurol. 2001;168:259–272. [PubMed]
- Satoh H. Cardiac actions of taurine as a modulator of the ion channels. Adv Exp Med Biol. 1998;442:121–128. [PubMed]
- Schaffer S, Takahashi K, Azuma J. Role of osmoregulation in the actions of taurine. Amino Acids. 2000;19:527–546. [PubMed]
- Schaffer SW, Azuma J, Mozaffari M. Role of antioxidant activity of taurine in diabetes. Can J Physiol Pharmacol. 2009;87:91–99. [PubMed]
- Selvaraj N, Bobby Z, Sathiyapriya V. Effect of lipid peroxides and antioxidants on glycation of hemoglobin: an in vitro study on human erythrocytes. Clin Chim Acta. 2006;366:190–195. [PubMed]
- Shao A, Hathcock JN. Risk assessment for the amino acids taurine, l-glutamine and l-arginine. Regul Toxicol Pharmacol. 2008;50:376–399. [PubMed]
- Sjovall J. Dietary glycine and taurine on bile acid conjugation in man; bile acids and steroids 75. Proc Soc Exp Biol Med. 1959;100:676–678. [PubMed]
- Son HY, Kim H, Y HK. Taurine prevents oxidative damage of high glucose-induced cataractogenesis in isolated rat lenses. J Nutr Sci Vitaminol (Tokyo) 2007;53:324–330. [PubMed]
- Spohr C, Brons C, Winther K, Dyerberg J, Vaag A. No effect of taurine on platelet aggregation in men with a predisposition to type 2 diabetes mellitus. Platelets. 2005;16:301–305. [PubMed]
- Stevens MJ, Lattimer SA, Kamijo M, Huysen C, Sima AA, Greene DA. Osmotically-induced nerve taurine depletion and the compatible osmolyte hypothesis in experimental diabetic neuropathy in the rat. Diabetologia. 1993;36:608–614. [PubMed]
- Stevens MJ, Hosaka Y, Masterson JA, Jones SM, Thomas TP, Larkin DD. Downregulation of the human taurine transporter by glucose in cultured retinal pigment epithelial cells. Am J Physiol. 1999;277:E760–E771. [PubMed]
- Sturman JA. Dietary taurine and feline reproduction and development. J Nutr. 1991;121:S166–S170. [PubMed]
- Suzuki T, Suzuki T, Wada T, Saigo K, Watanabe K. Taurine as a constituent of mitochondrial tRNAs: new insights into the functions of taurine and human mitochondrial diseases. EMBO J. 2002;21:6581–6589. [PMC free article] [PubMed]
- Tang C, Han P, Oprescu AI, Lee SC, Gyulkhandanyan AV, Chan GN, Wheeler MB, Giacca A. Evidence for a role of superoxide generation in glucose-induced beta-cell dysfunction in vivo. Diabetes. 2007;56:2722–2731. [PubMed]
- Tenner TE, Jr, Zhang XJ, Lombardini JB. Hypoglycemic effects of taurine in the alloxan-treated rabbit, a model for type 1 diabetes. Adv Exp Med Biol. 2003;526:97–104. [PubMed]
- Tokunaga H, Yoneda Y, Kuriyama K. Protective actions of taurine against streptozotocin-induced hyperglycemia. Biochem Pharmacol. 1979;28:2807–2811. [PubMed]
- Tokunaga H, Yoneda Y, Kuriyama K. Streptozotocin-induced elevation of pancreatic taurine content and suppressive effect of taurine on insulin secretion. Eur J Pharmacol. 1983;87:237–243. [PubMed]
- Trachtman H, Futterweit S, Maesaka J, Ma C, Valderrama E, Fuchs A, Tarectecan AA, Rao PS, Sturman JA, Boles TH, et al. Taurine ameliorates chronic streptozocin-induced diabetic nephropathy in rats. Am J Physiol. 1995;269:F429–F438. [PubMed]
- Tsuboyama-Kasaoka N, Shozawa C, Sano K, Kamei Y, Kasaoka S, Hosokawa Y, Ezaki O. Taurine (2-aminoethanesulfonic acid) deficiency creates a vicious circle promoting obesity. Endocrinology. 2006;147:3276–3284. [PubMed]
- Ulrich-Merzenich G, Zeitler H, Vetter H, Bhonde RR. Protective effects of taurine on endothelial cells impaired by high glucose and oxidized low density lipoproteins. Eur J Nutr. 2007;46:431–438. [PubMed]
- Vilchis C, Salceda R. Effect of diabetes on levels and uptake of putative amino acid neurotransmitters in rat retina and retinal pigment epithelium. Neurochem Res. 1996;21:1167–1171. [PubMed]
- Wang LJ, Yu YH, Zhang LG, Wang Y, Niu N, Li Q, Guo LM. Taurine rescues vascular endothelial dysfunction in streptozocin-induced diabetic rats: correlated with downregulation of LOX-1 and ICAM-1 expression on aortas. Eur J Pharmacol. 2008;597:75–80. [PubMed]
- Winiarska K, Szymanski K, Gorniak P, Dudziak M, Bryla J. Hypoglycaemic, antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits. Biochimie. 2009;91:261–270. [PubMed]
- Wu N, Lu Y, He B, Zhang Y, Lin J, Zhao S, Zhang W, Li Y, Han P. Taurine prevents free fatty acid-induced hepatic insulin resistance in association with inhibiting JNK1 activation and improving insulin signaling in vivo. Diabetes Res Clin Pract. 2010;90(3):288–296. [PubMed]
- Xiao C, Giacca A, Lewis GF. Oral taurine but not N-acetylcysteine ameliorates NEFA-induced impairment in insulin sensitivity and beta cell function in obese and overweight, non-diabetic men. Diabetologia. 2008;51:139–146. [PubMed]
- Yamori Y, Liu L, Ikeda K, Miura A, Mizushima S, Miki T, Nara Y. Distribution of twenty-four hour urinary taurine excretion and association with ischemic heart disease mortality in 24 populations of 16 countries: results from the WHO-CARDIAC study. Hypertens Res. 2001;24:453–457. [PubMed]
- Yao HT, Lin P, Chang YW, Chen CT, Chiang MT, Chang L, Kuo YC, Tsai HT, Yeh TK. Effect of taurine supplementation on cytochrome P450 2E1 and oxidative stress in the liver and kidneys of rats with streptozotocin-induced diabetes. Food Chem Toxicol. 2009;47:1703–1709. [PubMed]
- Yokogoshi H, Mochizuki H, Nanami K, Hida Y, Miyachi F, Oda H. Dietary taurine enhances cholesterol degradation and reduces serum and liver cholesterol concentrations in rats fed a high-cholesterol diet. J Nutr. 1999;129:1705–1712. [PubMed]
- Yu X, Xu Z, Mi M, Xu H, Zhu J, Wei N, Chen K, Zhang Q, Zeng K, Wang J, et al. Dietary taurine supplementation ameliorates diabetic retinopathy via anti-excitotoxicity of glutamate in streptozotocin-induced Sprague-Dawley rats. Neurochem Res. 2008;33:500–507. [PubMed]
- Zeng K, Xu H, Mi M, Zhang Q, Zhang Y, Chen K, Chen F, Zhu J, Yu X. Dietary taurine supplementation prevents glial alterations in retina of diabetic rats. Neurochem Res. 2009;34:244–254. [PubMed]
- Zeng K, Xu H, Mi M, Chen K, Zhu J, Yi L, Zhang T, Zhang Q, Yu X. Effects of taurine on glial cells apoptosis and taurine transporter expression in retina under diabetic conditions. Neurochem Res. 2010;35:1566–1574. [PubMed]
- Zeng K, Xu H, Chen K, Zhu J, Zhou Y, Zhang Q, Mantian M. Effects of taurine on glutamate uptake and degradation in M ller cells under diabetic conditions via antioxidant mechanism. Mol Cell Neurosci. 2010;45:192–199. [PubMed]
- Zhang C, Yang J, Jennings LK. Leukocyte-derived myeloperoxidase amplifies high-glucose-induced endothelial dysfunction through interaction with high-glucose-stimulated, vascular non-leukocyte-derived reactive oxygen species. Diabetes. 2004;53:2950–2959. [PubMed]